Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Большинство онкологов в России НЕ используют молекулярно-генетические тесты. Потому что не имеют достаточного опыта работы с ними и специфических знаний. Не получится просто открыть отчет и «списать» оттуда лечение
Нужно принимать во внимание множество факторов, понимать, как все эти многочисленные мутации влияют друг на друга, на рост опухоли, на потенциальную индивидуальную переносимость пациентом препарата и т. п
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Необходимо продумывать комбинации из таргетных препаратов, уметь сочетать их химиотерапевтическими лекарствами, предусматривать возможные побочные эффекты таких «коктейлей». Это довольно сложная задача — и врач должен быть очень мотивирован постоянно учиться.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Так что, хоть нам в международной клинике Медика24 и приходится все время держать мозги в тонусе, разбираться в новых и новых исследованиях генетических мутаций — результаты определенно того стоят.
Будьте здоровы.
Материал подготовлен заместителем главного врача по лечебной работе международной клиники Медика24, кандидатом медицинских наук Сергеевым Петром Сергеевичем.
Что такое изобретение и полезная модель?
Изобретения и полезные модели – это новые, ранее неизвестные технические решения, применимые в той или иной сфере человеческой деятельности. В некоторых странах понятие полезной модели входит в понятие изобретения. Но в российском законодательстве они разграничиваются.
Под изобретениями понимается техническое решение в любой области, относящееся к продукту (в частности, устройству, веществу, штамму микроорганизма, культуре клеток растений или животных) или способу (процессу осуществления действий над материальным объектом с помощью материальных средств), в том числе к применению продукта или способа по определенному назначению (п. 1 ст. 1350 ГК РФ).
Полезной моделью считается исключительно техническое решение, относящееся к определенному устройству (п. 1 ст. 1351 ГК РФ).
Что такое EGFR?
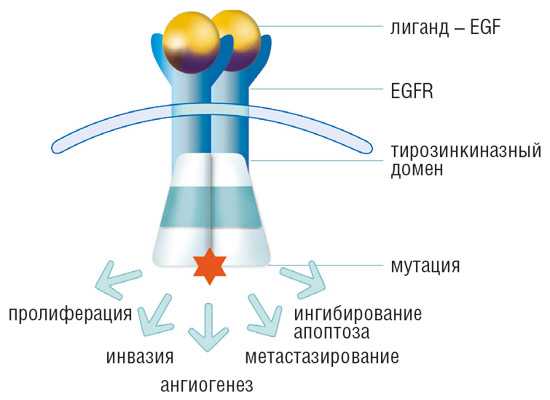
- EGFR – трансмембранный рецептор, активирующийся при связывании с эпидермальным фактором роста, трансформирующим фактором роста-α, амфирегулином.
- При активации EGFR внутри клетки запускается каскад биохимических реакций, приводящих к повышению пролиферации малигнизированных (опухолевых) клеток, росту опухоли, стимуляции процессов инвазии, патологического ангиогенеза и метастазирования.
- Рецептор EGFR кодируется геном EGFR.
В ряде опухолей обнаруживаются аномальные рецепторы эпидермального фактора роста, что обусловлено наличием мутации в соответствующем гене. В клетках с мутацией происходит активация сигнального пути EGFR, что, в свою очередь, инициирует процессы злокачественной трансформации в большинстве опухолей. Сигнальные пути контролируют процессы пролиферации, апоптоза – одного из механизмов клеточной гибели, утраты способности клеток к дифференцировке, процессы ангиогенеза и метастазирования.
Споры
Патенты Myriad Genetics на человеческие гены стали весьма спорными. Поскольку гены естественным образом встречаются у каждого человека, некоторые считают, что помимо вопросов морали, патенты являются препятствием для биомедицинских исследований во всем мире. Кроме того, открытие их отношения к раку груди финансировалась общественностью.
Myriad Genetics выступила ответчиком по делу Ассоциация молекулярной патологии против Myriad Genetics (ранее Association For Molecular Pathology et al. v. Ведомство США по патентам и товарным знакамЮристы ACLU выступал в качестве адвоката истцов. В иске медицинские ассоциации, врачи и пациенты подали в суд на Myriad Genetics, чтобы бросить вызов семи Соединенным Штатам. патенты на гены относится к рак молочной железы и рак яичников.
Два патента компании на BRCA1 и BRCA2 гены были признаны недействительными 29 марта 2010 г. судьей Роберт В. Свит в Окружной суд США Южного округа Нью-Йорка. По апелляции Апелляционный суд федерального округа отменил решение суда первой инстанции от 29 июля 2011 г. и постановил, что гены имеют право на патенты.
7 декабря 2011 года ACLU подал прошение о судебный приказ к Верховный суд. 26 марта 2012 г. Верховный суд отменил решение Федерального округа и вернул дело на новое рассмотрение в свете Mayo Collaborative Services против Prometheus Laboratories, Inc., в котором Верховный суд всего шестью днями ранее постановил, что необходимы более строгие правила для патентования наблюдений за природными явлениями.
16 августа 2012 года Федеральный округ подтвердил право Myriad патентовать гены, хотя они отказали в праве на патентное сравнение последовательностей ДНК. 30 ноября 2012 года Верховный суд согласился рассмотреть вторую жалобу на два генных патента, принадлежащих Myriad. Устный спор состоялся 15 апреля 2013 года. 13 июня 2013 г. в г. Ассоциация молекулярной патологии против Myriad Genetics (№ 12-398) Верховный суд США единогласно постановил, что «встречающийся в природе сегмент ДНК является продуктом природы и не имеет права на патент только потому, что он был изолирован», что аннулировало патенты Myriad на гены BRCA1 и BRCA2. Однако Суд также постановил, что манипулирование геном с целью создания чего-то, чего не встречается в природе — например, цепи синтетической комплементарной ДНК (кДНК) — все еще может подлежать патентной защите.
Австралия: Д’Арси против Myriad Genetics Inc (2015)
Myriad Genetics также участвовала в судебных разбирательствах в Австралии по поводу патентоспособности Последовательности ДНК. Касательно BRCA1, компания преуспела в Федеральный суд, как в первой инстанции, так и в апелляционной инстанции, но в октябре 2015 года проиграли единогласным решением Высший суд, Д’Арси против Myriad Genetics Inc.
В Австралии изобретение может быть запатентовано, если, прежде всего, это «способ изготовления». Множество голосов в Высоком суде сформулировали ключевой вопрос следующим образом: «Является ли заявленное изобретение производным продуктом или процессом, дающим результат в результате действий человека» (пункт ). Он постановил, что рассматриваемый продукт по-прежнему состоит в основном из генетической информации, которая возникает естественным образом, не была изменена в результате действий человека, поэтому не была «произведена» и, следовательно, не подлежала патентованию. Множественность отражала то, что более широкая концепция патентоспособности могла бы, как путем создания виртуальных монополий, так и путем размывания границ того, что может быть запатентовано, оказать сдерживающее воздействие на исследования и приложения, вопреки целям патентной защиты.
Истец сослался на недавнее решение Верховного суда США для сравнения. Высокий суд также осознавал, что его решение может противоречить недавним судебным решениям, а также законам о патентах других стран и, возможно, международным обязательствам Австралии; тем не менее, он считал, что это вопросы для законодательного органа, а также отрицал, что его решение в этом случае было направлено на создание прецедента в отношении генетического патентования в целом
Кроме того, остальные члены суда не возражали против заключительного замечания Гордона Дж.: «Важно отметить, что претензии, содержащиеся в патентах, рассматриваемых в исках в Соединенных Штатах Америки, рассматриваются в Ассоциация молекулярной патологии против Myriad Genetics Inc 186 L Ed 2d 124 (2013) были притязаниями на конкретные генетические последовательности и поэтому радикально отличались от оспариваемых притязаний в этой апелляции »(примечание 232)
Могут ли использовать изобретение, полезную модель или промышленный образец без согласия патентообладателя?
Правительство РФ имеет право в случае крайней необходимости, связанной с обеспечением обороны и безопасности государства, охраной жизни и здоровья граждан, принять решение об использовании изобретения, полезной модели или промышленного образца без согласия патентообладателя. При этом он вправе получить соразмерную компенсацию (п. 1 ст. 1360 ГК РФ).
Методика определения размера компенсации и порядок ее выплаты утверждены Постановлением Правительства РФ от 18 октября 2021 г. № 1767. В п. 2 этого постановления указано, что размер компенсации составляет 0,5% выручки лица, которое воспользовалось правом использования изобретения, полезной модели или промышленного образца без согласия патентообладателя. Под выручкой подразумевается та, что получена от производства и реализации товаров, выполнения работ и оказания услуг, для производства, выполнения и оказания которых использованы соответствующие изобретение, полезная модель или промышленный образец.
С 7 марта 2022 г. этот порядок был изменен. Указанную компенсацию не будут выплачивать патентообладателям, связанным с иностранными государствами, которые совершают в отношении российских юридических и физических лиц недружественные действия. Компенсация патентообладателя обнулится, если он имеет гражданство одного из этих государств либо если местом его регистрации, местом преимущественного ведения им хозяйственной деятельности или местом преимущественного извлечения им прибыли от деятельности является такое государство (Постановление Правительства РФ от 6 марта 2022 г. № 299, опубликовано на официальном портале правовой информации 7 марта 2022 г.). Перечень недружественных стран утвержден Распоряжением Правительства РФ от 5 марта 2022 г. № 430-р.
Похожие термины:
-
подача заявки на изобретение в зарубежное патентное ведомство с целью получения правовой охраны для этого изобретения на территории соответствующего зарубежного государства или подача заявки н
-
(США)-случай, когда первый патент выдан на внесение ограничения в производстве, а второй-на снятие этого ограничения. По патентному законодательству, например в США, второй патент не выдается, а в с
-
В некоторых государствах законодательно предусмотрена возможность выдачи патента только автору или его правопреемнику, причем имя автора должно быть названо в заявочной документации и патенте,
-
Характеризуется тем, что заявка подвергается экспертизе для выяснения новизны предполагаемого изобретения и других признаков, предусмотренных патентным законодательством.
-
При этой системе заявка рассматривается только для выяснения вопросов: – соблюдены ли заявителем формальные требования; – не испрашивает ли заявитель патент на объекты, которые нельзя патентова
-
отражаемое в охранных документах изменение активности изобретательской деятельности в исследуемой области техники за определенный период времени. При исследовании динамики патентования опред
-
Модификация исследовательской системы. При ней отменяется обязательная экспертиза всех поступающих заявок. Экспертиза проводится только по просьбе заявителя либо любого заинтересованного лица
-
авторская В некоторых государствах законодательно предусмотрена возможность выдачи патента только автору или его правопреемнику, причем имя автора должно быть названо в заявочной документации
-
система, при которой патент выдается любому первому заявителю на имя, будь то автор, либо законный правопреемник автора, либо лицо, присвоившее изобретение действительного автора.
-
система, при которой патент может получить лишь автор либо его правопреемник, причем имя автора должно быть названо в заявочной документации и в патенте, за исключением случаев, когда сам автор и з
-
целью патентования изобретений за рубежом являются: охрана экспортных поставок объектов техники и технологии, в которых использованы изобретения; продажа лицензий иностранным фирмам на право ис
-
статья 7.28 Кодекса об административных правонарушениях, в соответствии с которой: Нарушение установленного порядка патентования объектов промышленной собственности в иностранных государствах-в
-
осуществляется для обеспечения различных экономических интересов самого изобретателя, предприятия или государства в целом. Одной из главных целей зарубежного патентования в международной прак
Генные мутации при бесплодии
В литературе описано более тысячи мутаций и полиморфизмов в гене CFTR. Возникающие мутации делятся на пять классов в зависимости от степени и типа изменений, вызванных синтезируемым транспортным белком. Таким образом, мутация гена CFTR является одной из основных причин генетических заболеваний. В их числе:
- врожденное отсутствие семявыносящих протоков (CAVD);
- двусторонняя врожденная аплазия сосудов (CBAVD);
- азооспермия, которая может быть вызвана отсутствием семявыносящего протока;
- криптозооспермия;
- задержка созревания сперматозоидов;
- патология придатка яичка и семенных пузырьков из-за аномального развития протока Вольфа.
Эти отклонения могут указывать на кистозный фиброз или проявляться независимо.
У женщин вторичная аменорея может возникать как симптом мутации CFTR, но такое бесплодие встречается редко, а беременность обычно хорошо переносится. Наиболее распространенной мутацией в гене CFTR является делеция трех нуклеотидов в экзоне 10, что приводит к недостатку фенилаланина в положении 508 белковой цепи (ΔF508), что составляет примерно 70% CF (мутация класса II).
CBAVD – самая легкая форма кистозного фиброза, однако в случае симптоматического муковисцидоза причиной бесплодия почти всегда (более 95%) будет CBAVD. В литературе сообщается, что примерно в 60-70% случаев двусторонняя врожденная аплазия сосудов является результатом мутации в гене CFTR, однако при отсутствии других симптомов муковисцидоза.
Поскольку функция ядерных желез не нарушается, хирургический сбор спермы в сочетании с ИКСИ дает хорошие результаты, в то время как оба партнера должны быть генетически протестированы на передачу мутации CFTR их потомству.
Еще одна мутация, вызывающая бесплодие, – это мутации в гене рецептора андрогенов. Ген андрогенного рецептора RA содержит полиморфную область CAG в экзоне 1. Изменяющееся количество тринуклеотидных повторов CAG коррелирует с активностью рецептора RA, вызывая ее увеличение или нарушение функции, что приводит к заболеванию и патологии. Подсчитано, что мутации в гене AR могут быть обнаружены у 2-3% мужчин с диагнозом азооспермия или тяжелая форма олигозооспермии.
Аналогичным образом, приводит к бесплодию мутация в гене INSL3-LGR8. Инсулиноподобный фактор типа 3 (INSL3) необходим для опускания яичек, в дополнение к другим факторам, таким как ЛГ, ФСГ и дигидротестостерон (ДГТ). INSL3 влияет на опускание яичек по семенной трубке внутриутробно. Мутации в гене, кодирующем INSL3 или его рецепторных генах (LGR8 и GREAT), нарушают функцию яичек и вызывают крипторхизм. Патологию можно лечить ХГЧ – метод эффективен примерно у 20-24% пациентов, из которых примерно у 20% рецидивирующий крипторхизм, или выполнять орхидопексию – эффективность 95%.
Как работают патенты
Система патентования существует для того, чтобы изобретатели могли защитить свои доходы, не засекречивая информацию. В обмен на публикацию спецификаций изобретения владельцы патентов получают эксклюзивные права на коммерческое применение продукта — обычно на 20 лет. Для того чтобы получить патент, заявка должна удовлетворять трем требованиям: изобретение должно быть новым, оригинальным и обладать потенциалом для коммерческого использования.
Эта система стимулирует компании инвестировать в исследования и разработки. Мало кто может поспорить, что люди, институты и корпорации должны иметь возможность защитить свои изобретения от недобросовестного использования. Лекарства, медицинские процедуры и диагностические анализы подпадают под патентное законодательство, и большинство ученых согласны, что прибыль от патента — награда за достижения и стимул для дальнейших исследований. Однако по части генов, белков и клеток возникают споры. Встречающиеся в природе организмы нельзя запатентовать, потому что их открывают, а не изобретают. Но что насчет их частей? Защитники генетического патентования доказывают, что обнаружение генов — это нетривиальный процесс и еще недавно на него тратились годы. Патентная система поощряет вложения в такие исследования и способствует развитию генетической медицины. Критики патентования, включая нобелевского лауреата Джона Салстона, рассуждают иначе: геномы всех растений, животных и тем более Homo sapiens существовали задолго до того, как стало возможным их прочитать. Методы секвенирования являются новыми и инновационными, но сами гены — нет. Таким образом, должна существовать возможность патентовать генетические технологии, к примеру, методы картирования генов и зонды для проверки их наличия, но не сами гены. Они должны остаться общей собственностью человечества. В 1993 году Джеймс Уотсон покинул должность главы проекта «Геном человека» после ссоры с Бернадин Хили, директором Национального института здоровья США, из-за планов по генетическому патентованию.
Салстон, Уотсон и другие противники генетического патентования считают такую чрезмерную защиту интеллектуальной собственности злом, поскольку она препятствует исследованиям. Если нужно покупать лицензии на изучение определенных генов, то мало кто будет этим заниматься. Слишком широкая трактовка патентных прав также приведет к взлету цен на генетические продукты, например на анализ на BRCA1, которым владеет Myriad, что ограничит к нему доступ.
Более того, ученые, получающие средства от государства или благотворительности, обычно публикуют свои последовательности по мере их расшифровки, и непорядочные компании могут использовать эти бесплатные данные для ускорения своих программ по идентификации генов, а затем патентовать результаты. Именно в этом обвинили Myriad, и Крейг Вентер отметил иронию того, что ежедневная публикация данных проектом «Геном человека» помогла дельцам получить сотни патентов.
После получения молекулярно-генетического профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В зависимости от запроса, такое исследование может занимать от 5 до 15 рабочих дней: одному пациенту нужно просто определить тип опухоли и уточнить рекомендованную терапию — достаточно проверить наличие базового набора из 20 мутаций ДНК по рекомендациям мировых онкологических ассоциаций. А другому, с редким диагнозом или резистентностью к стандартному лечению — нужно составить «молекулярный паспорт» опухоли, а для этого — секвенировать 400 генов.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
В итоге, из этого отчета врач получает максимально полный молекулярно-генетический профиль злокачественной опухоли. У него есть информация что именно лечим, какую конкретно поломку в клетке. Есть самое «свежее» понимание, какие препараты сегодня уже одобрены или доступны для использования в рамках клинических исследований.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения















![Этические проблемы (этика + генетика = генэтика). геном человека [энциклопедия, написанная четырьмя буквами]](http://zd-semya.ru/wp-content/uploads/c/1/7/c17d357fe2420d40b1e8127d71bbfe69.jpeg)


















